
硫酸
- 全國咨詢熱線:
- 15115761776
詳情介紹:
硫酸(化學(xué)式:H2SO4),硫的重要的含氧酸。無水硫酸為無色油狀液體,10.36℃時結(jié)晶,通常使用的是它的各種不同濃度的水溶液,用塔式法和接觸法制取。前者所得為粗制稀硫酸,質(zhì)量分?jǐn)?shù)一般在75%左右;后者可得質(zhì)量分?jǐn)?shù)98.3%的純濃硫酸,沸點(diǎn)338℃,相對密度1.84。
硫酸是一種活潑的二元無機(jī)強(qiáng)酸,能和許多金屬發(fā)生反應(yīng)。高濃度的硫酸有強(qiáng)烈吸水性,可用作脫水劑,碳化木材、紙張、棉麻織物及生物皮肉等含碳水化合物的物質(zhì)。與水混合時,亦會放出大量熱能。其具有強(qiáng)烈的腐蝕性和氧化性,故需謹(jǐn)慎使用。是一種重要的工業(yè)原料,可用于制造肥料、藥物、炸藥、顏料、洗滌劑、蓄電池等,也廣泛應(yīng)用于凈化石油、金屬冶煉以及染料等工業(yè)中。常用作化學(xué)試劑,在有機(jī)合成中可用作脫水劑和磺化劑。
化學(xué)性質(zhì)
腐蝕性
純硫酸加熱至290℃分解放出部分三氧化硫,直至酸的濃度降到98.3%為止,這時硫酸為恒沸溶液,沸點(diǎn)為338°C。無水硫酸體現(xiàn)酸性是給出質(zhì)子的能力,純硫酸仍然具有很強(qiáng)的酸性,98%硫酸與純硫酸的酸性基本上沒有差別,而溶解三氧化硫的發(fā)煙硫酸是一種超酸體系,酸性強(qiáng)于純硫酸,但是廣泛存在一種誤區(qū),即稀硫酸的酸性強(qiáng)于濃硫酸,這種想法是錯誤的。的確,稀硫酸第一步電離完全,產(chǎn)生大量的水合氫離子H3O+;但是濃硫酸和水一樣,自身自偶電離會產(chǎn)生一部分硫酸合氫離子H3SO4+,正是這一部分硫酸合質(zhì)子,導(dǎo)致純硫酸具有非常強(qiáng)的酸性,雖然少,但是酸性卻要比水合質(zhì)子強(qiáng)得多,所以純硫酸的哈米特酸度函數(shù)高達(dá)-12.0。
在硫酸溶劑體系中,H3SO4+經(jīng)常起酸的作用,能質(zhì)子化很多物質(zhì)產(chǎn)生離子型化合物:
NaCl+ H2SO4==NaHSO4+HCl(不加熱都能很快反應(yīng))
KNO3+ H2SO4→K++HSO4-+HNO3
HNO3+ H2SO4→NO2++H3O++2HSO4-
CH3COOH+ H2SO4→CH3C(OH)2++HSO4-
HSO3F+ H2SO4→H3SO4++SO3F-(氟磺酸酸性更強(qiáng))
上述與HNO3的反應(yīng)所產(chǎn)生的NO2+,有助于芳香烴的硝化反應(yīng)。
濃硫酸特性
1.脫水性
脫水指濃硫酸脫去非游離態(tài)水分子或按照水的氫氧原子組成比脫去有機(jī)物中氫氧元素的過程。就硫酸而言,脫水性是濃硫酸的性質(zhì),而非稀硫酸的性質(zhì),濃硫酸有脫水性且脫水性很強(qiáng),脫水時按水的組成比脫去。物質(zhì)被濃硫酸脫水的過程是化學(xué)變化,反應(yīng)時,濃硫酸按水分子中氫氧原數(shù)的比(2:1)奪取被脫水物中的氫原子和氧原子或脫去非游離態(tài)的結(jié)晶水,如五水硫酸銅(CuSO4·5H2O)。

C12H22O11==濃硫酸==12C+11H2O
同時進(jìn)行碳與濃硫酸反應(yīng):
C+2H2SO4(濃)==加熱==CO2↑+2SO2↑+2H2O
2.強(qiáng)氧化性
(1)與金屬反應(yīng)
①常溫下濃硫酸能使鐵、鋁等金屬鈍化。②加熱時,濃硫酸可以與除金、鉑之外的所有金屬反應(yīng),生成高價金屬硫酸鹽,本身一般被還原成二氧化硫。
Cu+2H2SO4(濃)==加熱==CuSO4+SO2↑+2H2O
2Fe+6H2SO4(濃)==加熱==Fe2(SO4)3+3SO2↑+6H2O
在上述反應(yīng)中,硫酸表現(xiàn)出了強(qiáng)氧化性和酸性。
(2)與非金屬反應(yīng)
熱的濃硫酸可將碳、硫、磷等非金屬單質(zhì)氧化到其高價態(tài)的氧化物或含氧酸,本身被還原為二氧化硫。在這類反應(yīng)中,濃硫酸只表現(xiàn)出氧化性。
C+2H2SO4(濃)=加熱=CO2↑+2SO2↑+2H2O
S+H2SO4(濃)==加熱==3SO2↑+2H2O
(3)與其他還原性物質(zhì)反應(yīng)
濃硫酸具有強(qiáng)氧化性,實(shí)驗(yàn)室制取硫化氫、溴化氫、碘化氫等還原性氣體不能選用濃硫酸。
H2S+H2SO4(濃)==S↓+SO2↑+2H2O
2HBr+H2SO4(濃)==Br2↑+SO2↑+2H2O
2HI+H2SO4(濃)==I2↓+SO2↑+2H2O
稀硫酸特性
性質(zhì)
可與多數(shù)金屬(比銅活潑)和絕大多數(shù)金屬氧化物反應(yīng),生成相應(yīng)的硫酸鹽和水;
可與所含酸根離子對應(yīng)酸酸性比硫酸根離子弱的鹽反應(yīng),生成相應(yīng)的硫酸鹽和弱酸;
可與堿反應(yīng)生成相應(yīng)的硫酸鹽和水;
可與氫前金屬在一定條件下反應(yīng),生成相應(yīng)的硫酸鹽和氫氣;
加熱條件下可催化蛋白質(zhì)、二糖和多糖的水解;
能與指示劑作用,使紫色石蕊試液變紅,使無色酚酞試液不變色。
檢驗(yàn)
所需藥品:經(jīng)過鹽酸酸化的氯化鋇溶液,鎂粉。
檢驗(yàn)方法:使用經(jīng)過鹽酸(HCl)酸化的的氯化鋇(BaCl2)。向待測物溶液滴入幾滴經(jīng)過鹽酸酸化的氯化鋇溶液,震蕩,如果產(chǎn)生白色沉淀;向溶液中加入鎂粉后生成可燃性氣體,則待測溶液中含有硫酸。但此方法僅限中學(xué)階段。
常見誤區(qū)
稀硫酸在中學(xué)階段,一般當(dāng)成H2SO4=2H++SO42-,兩次完全電離,其實(shí)不是這樣的。根據(jù)硫酸酸度系數(shù)pKa1=-3.00,pKa2=1.99,其二級電離不夠充分,在稀硫酸中HSO4-=可逆=H++SO42-,并未完全電離,1mol/L的硫酸一級電離完全,二級電離約電離10%,也就是溶液中仍存在大量的HSO4-。而即使是NaHSO4溶液0.1mol/L時,硫酸氫根也只電離了約30%。
硫酸是一種活潑的二元無機(jī)強(qiáng)酸,能和許多金屬發(fā)生反應(yīng)。高濃度的硫酸有強(qiáng)烈吸水性,可用作脫水劑,碳化木材、紙張、棉麻織物及生物皮肉等含碳水化合物的物質(zhì)。與水混合時,亦會放出大量熱能。其具有強(qiáng)烈的腐蝕性和氧化性,故需謹(jǐn)慎使用。是一種重要的工業(yè)原料,可用于制造肥料、藥物、炸藥、顏料、洗滌劑、蓄電池等,也廣泛應(yīng)用于凈化石油、金屬冶煉以及染料等工業(yè)中。常用作化學(xué)試劑,在有機(jī)合成中可用作脫水劑和磺化劑。
化學(xué)性質(zhì)
腐蝕性
純硫酸加熱至290℃分解放出部分三氧化硫,直至酸的濃度降到98.3%為止,這時硫酸為恒沸溶液,沸點(diǎn)為338°C。無水硫酸體現(xiàn)酸性是給出質(zhì)子的能力,純硫酸仍然具有很強(qiáng)的酸性,98%硫酸與純硫酸的酸性基本上沒有差別,而溶解三氧化硫的發(fā)煙硫酸是一種超酸體系,酸性強(qiáng)于純硫酸,但是廣泛存在一種誤區(qū),即稀硫酸的酸性強(qiáng)于濃硫酸,這種想法是錯誤的。的確,稀硫酸第一步電離完全,產(chǎn)生大量的水合氫離子H3O+;但是濃硫酸和水一樣,自身自偶電離會產(chǎn)生一部分硫酸合氫離子H3SO4+,正是這一部分硫酸合質(zhì)子,導(dǎo)致純硫酸具有非常強(qiáng)的酸性,雖然少,但是酸性卻要比水合質(zhì)子強(qiáng)得多,所以純硫酸的哈米特酸度函數(shù)高達(dá)-12.0。
在硫酸溶劑體系中,H3SO4+經(jīng)常起酸的作用,能質(zhì)子化很多物質(zhì)產(chǎn)生離子型化合物:
NaCl+ H2SO4==NaHSO4+HCl(不加熱都能很快反應(yīng))
KNO3+ H2SO4→K++HSO4-+HNO3
HNO3+ H2SO4→NO2++H3O++2HSO4-
CH3COOH+ H2SO4→CH3C(OH)2++HSO4-
HSO3F+ H2SO4→H3SO4++SO3F-(氟磺酸酸性更強(qiáng))
上述與HNO3的反應(yīng)所產(chǎn)生的NO2+,有助于芳香烴的硝化反應(yīng)。
濃硫酸特性
1.脫水性
脫水指濃硫酸脫去非游離態(tài)水分子或按照水的氫氧原子組成比脫去有機(jī)物中氫氧元素的過程。就硫酸而言,脫水性是濃硫酸的性質(zhì),而非稀硫酸的性質(zhì),濃硫酸有脫水性且脫水性很強(qiáng),脫水時按水的組成比脫去。物質(zhì)被濃硫酸脫水的過程是化學(xué)變化,反應(yīng)時,濃硫酸按水分子中氫氧原數(shù)的比(2:1)奪取被脫水物中的氫原子和氧原子或脫去非游離態(tài)的結(jié)晶水,如五水硫酸銅(CuSO4·5H2O)。

濃硫酸迅速蝕穿毛巾
可被濃硫酸脫水的物質(zhì)一般為含氫、氧元素的有機(jī)物,其中蔗糖、木屑、紙屑和棉花等物質(zhì)中的有機(jī)物,被脫水后生成了黑色的炭,這種過程稱作炭化。一個典型的炭化現(xiàn)象是蔗糖的黑面包反應(yīng)。在200mL燒杯中放入20g蔗糖,加入幾滴水,水加適量,攪拌均勻。然后再加入15mL質(zhì)量分?jǐn)?shù)為98%的濃硫酸,迅速攪拌。觀察實(shí)驗(yàn)現(xiàn)象。可以看到蔗糖逐漸變黑,體積膨脹,形成疏松多孔的海綿狀的炭,反應(yīng)放熱,還能聞到刺激性氣體。C12H22O11==濃硫酸==12C+11H2O
同時進(jìn)行碳與濃硫酸反應(yīng):
C+2H2SO4(濃)==加熱==CO2↑+2SO2↑+2H2O
2.強(qiáng)氧化性
(1)與金屬反應(yīng)
①常溫下濃硫酸能使鐵、鋁等金屬鈍化。②加熱時,濃硫酸可以與除金、鉑之外的所有金屬反應(yīng),生成高價金屬硫酸鹽,本身一般被還原成二氧化硫。
Cu+2H2SO4(濃)==加熱==CuSO4+SO2↑+2H2O
2Fe+6H2SO4(濃)==加熱==Fe2(SO4)3+3SO2↑+6H2O
在上述反應(yīng)中,硫酸表現(xiàn)出了強(qiáng)氧化性和酸性。
(2)與非金屬反應(yīng)
熱的濃硫酸可將碳、硫、磷等非金屬單質(zhì)氧化到其高價態(tài)的氧化物或含氧酸,本身被還原為二氧化硫。在這類反應(yīng)中,濃硫酸只表現(xiàn)出氧化性。
C+2H2SO4(濃)=加熱=CO2↑+2SO2↑+2H2O
S+H2SO4(濃)==加熱==3SO2↑+2H2O

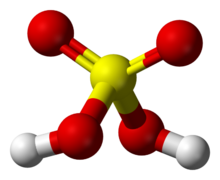
硫酸分子的球棍模型
2P+5H2SO4(濃)==加熱==2H3PO4+5SO2↑+2H2O(3)與其他還原性物質(zhì)反應(yīng)
濃硫酸具有強(qiáng)氧化性,實(shí)驗(yàn)室制取硫化氫、溴化氫、碘化氫等還原性氣體不能選用濃硫酸。
H2S+H2SO4(濃)==S↓+SO2↑+2H2O
2HBr+H2SO4(濃)==Br2↑+SO2↑+2H2O
2HI+H2SO4(濃)==I2↓+SO2↑+2H2O
稀硫酸特性
性質(zhì)
可與多數(shù)金屬(比銅活潑)和絕大多數(shù)金屬氧化物反應(yīng),生成相應(yīng)的硫酸鹽和水;
可與所含酸根離子對應(yīng)酸酸性比硫酸根離子弱的鹽反應(yīng),生成相應(yīng)的硫酸鹽和弱酸;
可與堿反應(yīng)生成相應(yīng)的硫酸鹽和水;
可與氫前金屬在一定條件下反應(yīng),生成相應(yīng)的硫酸鹽和氫氣;
加熱條件下可催化蛋白質(zhì)、二糖和多糖的水解;
能與指示劑作用,使紫色石蕊試液變紅,使無色酚酞試液不變色。
檢驗(yàn)
所需藥品:經(jīng)過鹽酸酸化的氯化鋇溶液,鎂粉。
檢驗(yàn)方法:使用經(jīng)過鹽酸(HCl)酸化的的氯化鋇(BaCl2)。向待測物溶液滴入幾滴經(jīng)過鹽酸酸化的氯化鋇溶液,震蕩,如果產(chǎn)生白色沉淀;向溶液中加入鎂粉后生成可燃性氣體,則待測溶液中含有硫酸。但此方法僅限中學(xué)階段。
常見誤區(qū)
稀硫酸在中學(xué)階段,一般當(dāng)成H2SO4=2H++SO42-,兩次完全電離,其實(shí)不是這樣的。根據(jù)硫酸酸度系數(shù)pKa1=-3.00,pKa2=1.99,其二級電離不夠充分,在稀硫酸中HSO4-=可逆=H++SO42-,并未完全電離,1mol/L的硫酸一級電離完全,二級電離約電離10%,也就是溶液中仍存在大量的HSO4-。而即使是NaHSO4溶液0.1mol/L時,硫酸氫根也只電離了約30%。







